Le patologie umane derivanti da adiuvanti vaccinali [1] (Human adjuvant disease o HAD) vengono inizialmente descritte nel secolo scorso come caratterizzate da manifestazioni cliniche e di laboratorio che includono patologie reumatiche di origine autoimmune (autoimmune rheumatic disease o ARD) come la sclerosi sistemica e da silicone (Silicone & systemic sclerosis o Ssc), il lupus eritematoso sistemico (systemic lupus erythematosus o SLE), l’artrite reumatoide (rheumatoid arthritis o RA) e la sindrome di Sjögren fra le altre in associazione con l’iniezione di sostanze estranee (paraffina e fluido siliconico), ma le manifestazioni più frequenti sono sintomi aspecifici come:
– artralgie e mialgie,
– deterioramento cognitivo,
– malessere (e febbricola costante, priva di specifica causa)
Tutti i tipi di adiuvanti in grado [2] d’indurre una risposta immunitaria innata sono sospettati d’indurre determinate patologie autoimmuni; fra tali adiuvanti – oltre al composto denominato “adiuvante di Freund”, sia in forma completa che incompleta – [3] l’ossi-idrossido di alluminio pare svolgere un ruolo particolare nell’insorgenza della Sjögren’s syndrome. Per questa ragione [3a] il potenziale di tale adiuvante nell’insorgenza di patologie autoimmuni dovrebbe essere particolarmente monitorato in tutti gli individui nei quali ci potrebbe essere appunto la predisposizione all’insorgenza
La sindrome di Sjögren [4] (tale definizione deriva dal nome del suo scopritore, Henrik Sjögren, oculista svedese che risiedeva e lavorava a Copenaghen e che la descrisse per la prima volta nel 1933) rappresenta una complessa patologia autoimmune cronica ad eziologia sconosciuta, cronica, [5] caratterizzata da infiltrazioni linfocitarie nelle ghiandole esocrine, diminuzione delle funzioni delle ghiandole secretorie salivali/lacrimali e dalla presenza di autoanticorpi circolanti. Può presentarsi come SjS primaria o secondaria, l’ultima delle quali avviene in concomitanza con una o più patologie autoimmuni quali le seguenti:
• artrite reumatoide,
• lupus eritematoso sistemico o LES,
• sclerodermia,
• cirrosi biliare primaria
[5]I progressi attuali nella prevenzione e trattamento terapeutici per la SjS sono ostacolati dalla mancanza di comprensione nella progressione fisiopatologica e clinica della malattia. [6] Attualmente è inesistente una cura specifica, anche poiché trattare tutti i sintomi della sindrome di Sjögren contemporaneamente è praticamente impossibile. Vi è tuttavia una speranza, rappresentata dalla recentissima [6a]scoperta dell’attivazione del percorso dell’interferone-1 (in inglese IFN-1), che svolge un ruolo importante nell’evoluzione della sindrome di Sjögren: molteplici terapie mirano a ridurre o addirittura inibire la produzione di IFN-1 che quindi potrebbe rappresentare un target per piani di trattamento futuri
In un [7]recente studio scientifico è stato rilevato che le cavie di laboratorio alle quali è stato inoculato l’adiuvante di Freund avevano solo anticorpi dimostrabili legati ad un peptide in particolare (fig. 1)
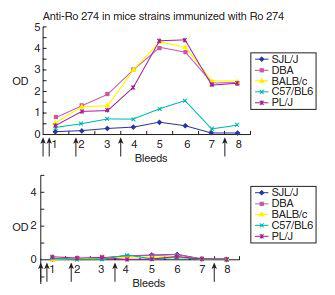
La proteina Ro273-289 è costituita come un peptide antigenico multiplo (multiple antigenic peptide o MAP) ed utilizzato in un test immunoenzimatico collegato: i sieri di vari ceppi prelevati dai topi immunizzati con un peptide monomero Ro273-289 – nel pannello superiore – e dai topi di controllo – nel pannello inferiore – sono stati studiati per il legame al peptide
(Le frecce si riferiscono al punto temporale dell’immunizzazione)
Nel succitato studio scientifico è stato dimostrato che tre dei cinque ceppi studiati hanno avuto una vigorosa risposta immunitaria alla profilassi alla quale erano stati sottoposti con il peptide corto da 60 kD Ro, mentre due ceppi no: gli autoaticorpi anti-SSA / Ro sono presenti a livelli significativamente alti in pazienti con malattie autoimmuni gravi e rappresentano un biomarker diagnostico standard per LES e sindrome di Sjögren [8].
I topi e le cavie immunizzati con brevi peptidi di 60 kDa Ro (SSA), noti per indurre diffusione di epitopi, sviluppano una risposta immunitaria alle particelle ribonucleoproteiche. Questi topi presentano infiltrazioni linfocitarie all’interno delle ghiandole salivari composte principalmente da cellule linfocitarie di tipo T CD4 + (45%), CD8 + (18%), CD19 + (35%) linfociti B in concomitanza con una significativa diminuzione della percentuale di flusso di saliva
La diffusione dell’epitopo è indicativa di minima tolleranza “Ro” e “La” nelle cellule linfocitarie di tipo B e nei compartimenti cellulari T [9-11]. Questo modello tuttavia necessita di profilassi vaccinale ripetuta con peptidi di tipo Ro emulsionati con adiuvante di Freund nel corso di diverse settimane senza che vi sia insorgenza delle patologie autoimmuni fino a 4 mesi dopo la profilassi effettuata, sollevando la questione di uno scenario eziologico completamente differente rispetto a quanto osservato nei pazienti affetti da LES e sindrome di Sjögren
Ciò implica che [2] l’adiuvante di Freund altera la risposta immunitaria sino a poter mascherare l’effettiva presenza degli autoanticorpi specifici della sindrome di Siögren, e cioè gli “Anti-Ro” [Sjögren’s syndrome antigen A (SSA)] [11] e gli “Anti-La” [Sjögren’s syndrome antigen B (SSB)]
Caratteristiche comuni nella sindrome di Sjögren che influenzano la qualità di vita di ogni individuo affetto sono la fatica e la ridotta capacità fisica. [12] È stato monitorato un gruppo di controllo ed in seguito si è potuto verificare che una maggiore attività sportiva –con effetti positivi anche sulle comorbidità, come la salute cardiovascolare– unita ad una migliorata capacità aerobica hanno portato ad una migliore gestione della fatica, avvertendola in maniera meno intensa, a differenza dei livelli di dolore, ansia e depressione che risultano invero senza modifiche
Bibliografia
[1] Olga Vera-Lastra, Gabriela Medina, Maria Del Pilar Cruz-Dominguez, Luis J Jara and Yehuda Shoenfeld. Autoimmune/inflammatory
syndrome induced by adjuvants (Shoenfeld’s syndrome): clinical and immunological spectrum | ISSN: 1744-666X
[2] Tegan N. Lavoie, Byung Ha Lee and Cuong Q. Nguyen. Current Concepts: Mouse Models of Sjögren’s Syndrome | doi:
10.1155/2011/549107
[3] Harini Bagavant, Seshagiri Rao Nandula, Paulina Kaplonek, Paulina D. Rybakowska and Cuong Q. Nguyen. Alum, an Aluminum Based Adjuvant, Induces Sjögren’s Syndrome-like Disorder in Mice | Published in final edited form as: Clin Exp Rheumatol. 2014 ; 32(2):
251–255
[3a] Pope JE, Stevens A, Howson W and Bell DA. The development of rheumatoid arthritis after recombinant hepatitis B vaccination
| J. Rheumatol. 25(9), 1687–1693 (1998
[4] A Note from Sweden: Recollection of Henrik Sjögren | doi: 10.1007/978-1-560327-957-4_2
[5] Tincani A, Andreoli L, Cavazzana I, et al. Novel aspects of Sjögren’s syndrome in 2012. | PubMed: 23556533
[6] National Institute of Arthritis and Muscoloskeletal and Skin Diseases. Questions and Answers about Sjögren’s Syndrome
[6a] Ann Igoe and R. Hal Scofield. Autoimmunity and infection in Sjögren’s Syndrome | doi: 10.1097/BOR.0b013e32836200d2
[7] B. T. Kurien, A. Dsouza, A. Igoe, Y. J. Lee, J. S. Maier-Moore, T. Gordon, M. Jackson and R. H. Scofield. “Immunization with 60 kD
Ro peptide produces different stages of preclinical autoimmunity in a Sjögren’s syndrome model among multiple strains of
inbred mice” | doi: 10.1111/cei.12094
[8] R. H. Scofield, S. Asfa, D. Obeso, R. Jonsson and B. T. Kurien, “Immunization with short peptides from the 60-kDa Ro antigen
recapitulates the serological and pathological findings as well as the salivary gland dysfunction of Sjögren’s syndrome” | Journal of
Immunology, vol. 175, no. 12, pp. 8409–8414, 2005
[9] C. L. Keech, T. P. Gordon and J. McCluskey, “The immune response to 52-kDa Ro and 60-kDa Ro is Linked in Experimental
Autoimmunity” | Journal of Immunology, vol. 157, no. 8, pp. 3694–3699, 1996.
[10] B. T. Kurien, S. Asfa, C. Li, Y. Dorri, R. Jonsson and R.H. Scofield. “Induction of oral tolerance in experimental Sjögren’s syndrome
autoimmunity” | Scandinavian Journal of Immunology, vol. 61, no. 5, pp. 418–425, 2005.
[11] P. Reynolds, T. P. Gordon, A. W. Purcell, D. C. Jackson and J. McCluskey. “Hierarchical self-tolerance to T cell determinants within the
ubiquitous nuclear self-antigen La (SS-B) permits induction of systemic autoimmunity in normal mice” | Journal of Experimental
Medicine, vol. 184, no. 5, pp. 1857–1870, 1996
[12] Theander E, Theander S, Karlelid L, Strömbeck B. “Sustained effects of a supervised aerobic exercise program (Nordic walking) in
women with primary Sjögren’s syndrome. A 4-year follow-up” | Abstract Book, 10th International Symposium on Sjögren’s
syndrome, Brest, France, October 1–3, 2009: p. 49


